Publié le 06.11.2023
Accélérer la recherche
Collectivement, les maladies cardiaques congénitales sont courantes, touchant 1 % des naissances, mais individuellement, elles peuvent correspondre à des troubles rares, nécessitant un diagnostic et un suivi spécialisés. Actuellement, la plupart des malformations de la structure du cœur ont une cause méconnue.
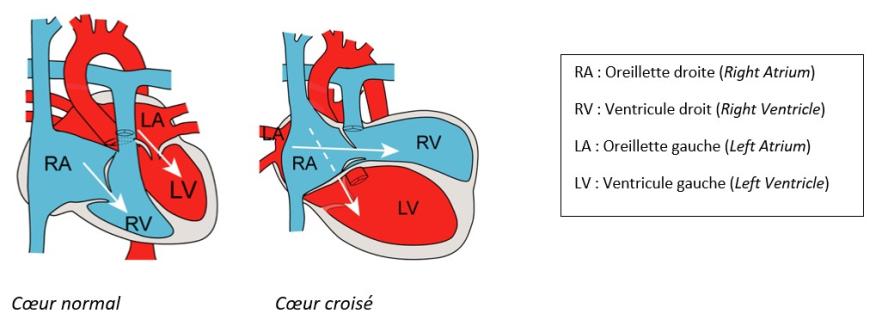
Le cœur croisé (ou criss-cross heart en anglais) est un exemple de malformation cardiaque très rare (fréquence de 1/125 000 naissances), dont la cause génétique et les mécanismes embryonnaires étaient inconnus. Cette pathologie se définit par des connexions anormales entre oreillettes et ventricules, ce qui entraîne un croisement des flux sanguins gauche et droit à l’échographie cardiaque. Le cœur croisé est presque toujours associé à d'autres anomalies cardiaques, comme des « branchements » anormaux du cœur aux artères, ou une position anormale des ventricules.
Le mécanisme de développement du cœur en « criss-cross » était encore inexpliqué. Ségolène Bernheim, cardiopédiatre et doctorante de l’équipe pluridisciplinaire « Morphogénèse du cœur » dirigée par Sigolène Meilhac à l’Institut Imagine (Inserm, AP-HP, Université Paris Cité) et à l’Institut Pasteur, a identifié le premier modèle de la maladie: une lignée de souris présentant une mutation du gène Greb1l, connue auparavant pour des malformations du rein. En étudiant jour par jour le développement embryonnaire, Ségolène Bernheim a ainsi pu mettre en évidence l’étape à partir de laquelle la formation du cœur devient anormale : le cœur embryonnaire bascule de manière inattendue à 90° par rapport à un cœur normal.
L’équipe a ensuite élucidé la cause de cette bascule anormale : la croissance du cœur est arrêtée, car il y a une pénurie de cellules cardiaques. En absence de Greb1l, ce défaut de croissance génère des contraintes mécaniques anormales, qui se répercutent sur la forme du cœur : mauvais positionnement des valves cardiaques et des ventricules.
La fonction du gène Greb1l était inconnue. Par des analyses moléculaires à grande échelle, l’équipe a finalement lié la fonction de Greb1l à deux mécanismes cellulaires : en premier, ce gène joue un rôle crucial dans la formation des ribosomes, la machinerie de la cellule qui fabrique les protéines ; en second, Greb1l contrôle l’apparition des cellules cardiaques, par le processus de différenciation cellulaire.
En l’absence de Greb1l, ces deux mécanismes cellulaires sont donc fortement affectés et perturbent le développement embryonnaire correct du cœur. Les travaux de l’équipe de Sigolène Meilhac permettent ainsi de reconstruire les mécanismes par lesquels la malformation du cœur croisé survient pendant la grossesse. Ce travail a été possible notamment grâce à la synergie entre la recherche fondamentale conduite à l’Institut Imagine et la recherche clinique et génétique menée auprès des patients de l'AP-HP sur le site de l’hôpital Necker-Enfants Malades. ll contribue ainsi directement à une meilleure prise en charge des patients et information des familles.
Le gène GREB1L est connu pour être impliqué dans d’autres maladies humaines : malformations du rein, déficiences auditives, anomalies squelettiques ou génitales. Les mécanismes cellulaires révélés dans cette étude des cellules cardiaques seront utiles pour mieux comprendre l’origine des maladies associées à GREB1L dans les autres organes.